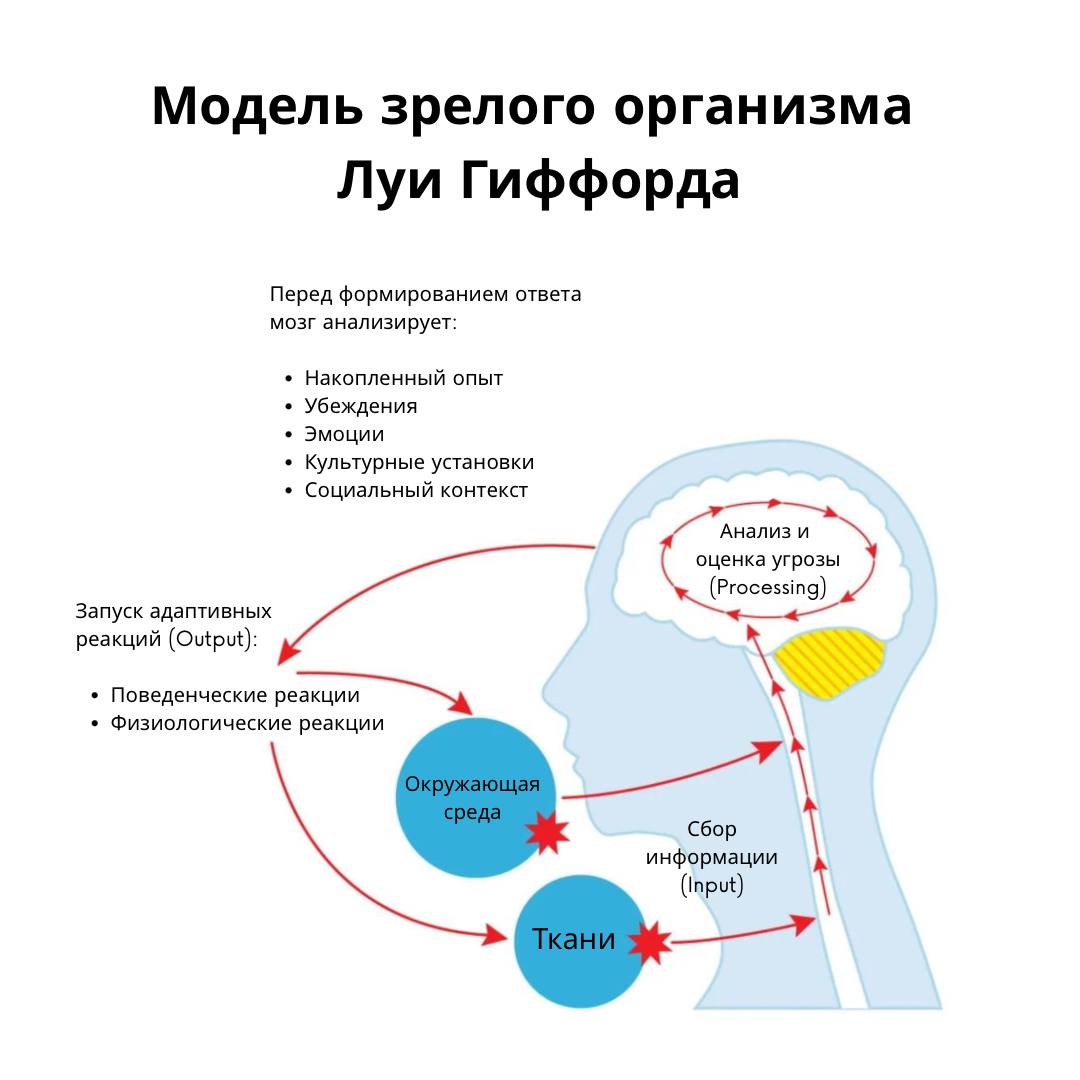
Вероятность развития посттравматического остеоартрита (ПТОА) у пациентов с незначительными повреждениями менисков в 3 раза выше, чем у пациентов со здоровыми менисками, а при серьезных повреждениях менисков у лиц 50-79 лет эта цифра увеличивается почти в 8 раз (Englund, 2009).
У пациентов, перенесших менискэктомию, примерно в 50% случаев развивается ПТОА в течение последующих 10-20 лет, что в 10 раз превышает относительный риск для здоровой референтной популяции (Lohmander6 2007). Аналогичным образом, неудачное восстановление после травмы мениска связано с 5-кратным увеличением риска развития ПТОА (Rönnbla, 2021).
Однако факторы, способствующие развитию ПТОА, до сих пор остаются неясными.
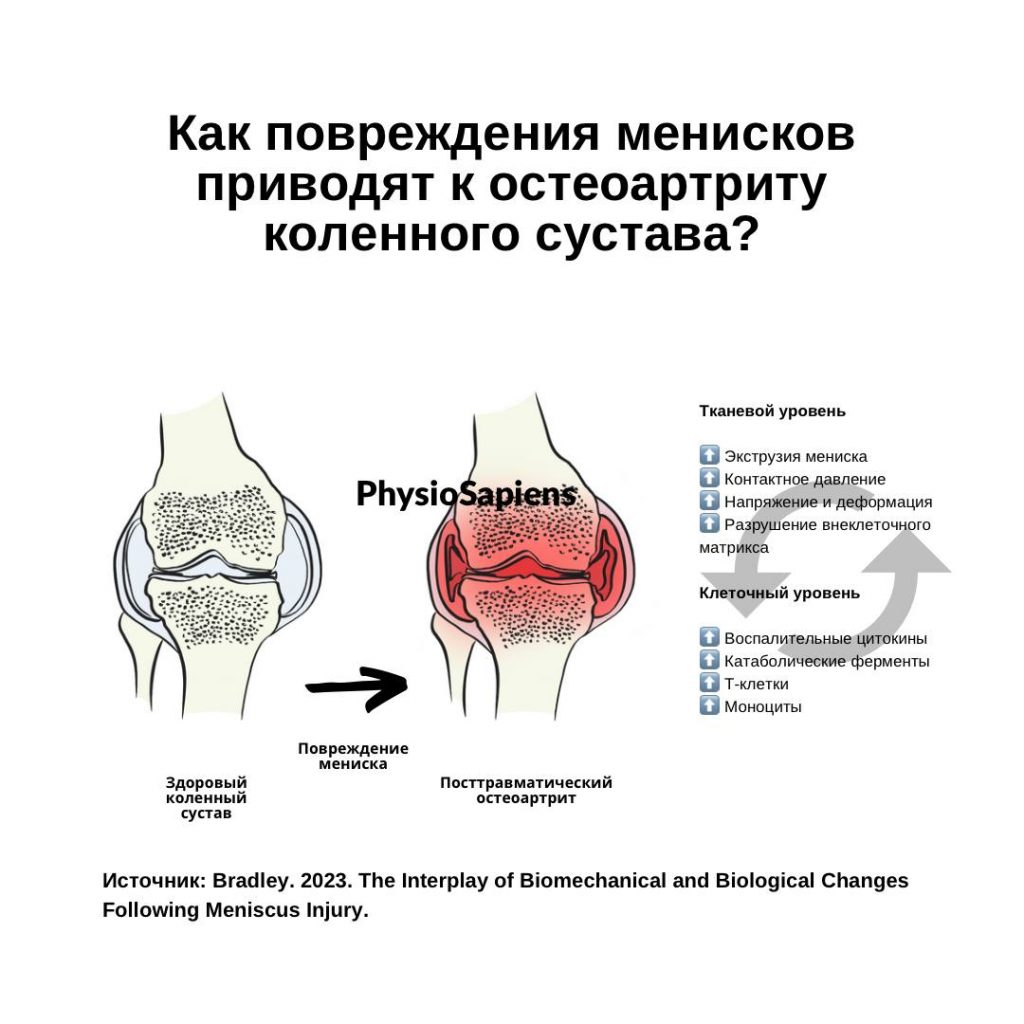
Поэтому Bradley и соавт. (2023) в своем исследовании рассмотрели основные причины, способствующие такому значительному увеличению риска. Авторы зафиксировали связь биологических и биомеханических факторов, которые возникают после повреждения менисков.
С биомеханической точки зрения повреждения мениска часто приводят к увеличению экструзии мениска и изменению напряжений и деформаций в суставе (Bedi, 2010; Crema, 2012; Englund, 2012).
При травме мениска напряжение вдоль окружно ориентированных коллагеновых волокон, называемое напряжением обруча, нарушается, что делает мениск более восприимчивым к экструзии (MacLeod, 2014; Patel, 2016).
Экструзия мениска может быть довольно проблематичной, поскольку она делает суставной хрящ более восприимчивым к снижению конгруэнтности сустава и более высоким контактным нагрузкам (Crema, 2012; Patel, 2016).
Например, исследования на трупах показали, что удаление медиального мениска может увеличить контактное напряжение между сочленяющимися хрящевыми поверхностями на 100%, а удаление латерального мениска — на 200-300% (Fox, 2012).
Биологически эти нарушения механической нагрузки приводят к повышению уровня провоспалительных и катаболических факторов, которые препятствуют заживлению мениска. Повреждение мениска часто приводит к повышению уровня воспалительных цитокинов, таких как интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6) и фактора некроза опухоли-α (ФНО-α), повышению уровня катаболических ферментов, таких как матриксные металлопротеиназы (MMП), увеличению количества Т-клеток и потенциальному увеличению количества моноцитов.
В течение первых 24 часов после острой травмы колена в синовиальной жидкости повышается концентрация ИЛ-1β, ИЛ-6 и ФНО-α (Swärd, 2012). Через 3 и более месяцев после травмы концентрация ИЛ-6, ИЛ-8, ФНО-α и ИЛ-10 в травмированных коленях выше по сравнению с нормальными коленями, а антагонист рецептора ИЛ-1 (ИЛ-1Ra) и ИЛ-1β значительно ниже (Bigoni, 2017).
Эти воспалительные цитокины являются важными регуляторами многочисленных катаболических ферментов, включая MMP. Коллагеназы MMP-1, MMP-8, MMP-13 и мембранная MMP типа 1 могут расщеплять неповрежденные трехспиральные коллагеновые фибриллы на фрагменты длиной в одну четверть и три четверти (Billinghurst, 1997), которые впоследствии дегенерируют под воздействием других MMP, таких как MMP-2 и MMP-9 (Murphy, 2008).
Таким образом, повышение активности ММP и провоспалительного медиатора простагландина Е2 (ПГЕ2) в синовиальной жидкости поврежденного колена приводит к усилению провоспалительной и катаболической среды, что может способствовать развитию ПТОА (Liu, 2017).
Аналогичным образом, повреждение мениска приводит к формированию богатой иммунными клетками суставной среды, которая состоит в основном из Т-клеток с несколькими фенотипами Т-хелперов и моноцитов (Kim-Wan, 2021).
Повышение уровня моноцитов после повреждения мениска предполагает, что эти клетки могут мигрировать в сустав и дифференцироваться в провоспалительные макрофаги M1, которые могут высвобождать воспалительные цитокины, а именно ИЛ-1, ИЛ-6, ИЛ-12 и ФНО-α (Woodell-May, 2020).
Эти изменения в целом способствуют развитию воспаления и разрушению внеклеточного матрикса, что приводит к снижению механических свойств ткани, а также к подавлению клеточной пролиферации и восстановления. Двустороннее нарушение биомеханического и биологического гомеостаза приводит к циклу положительной обратной связи, в котором каждый фактор усиливает дегенерацию, вызванную другим, в результате чего создается устойчивая среда, препятствующая восстановлению тканей.