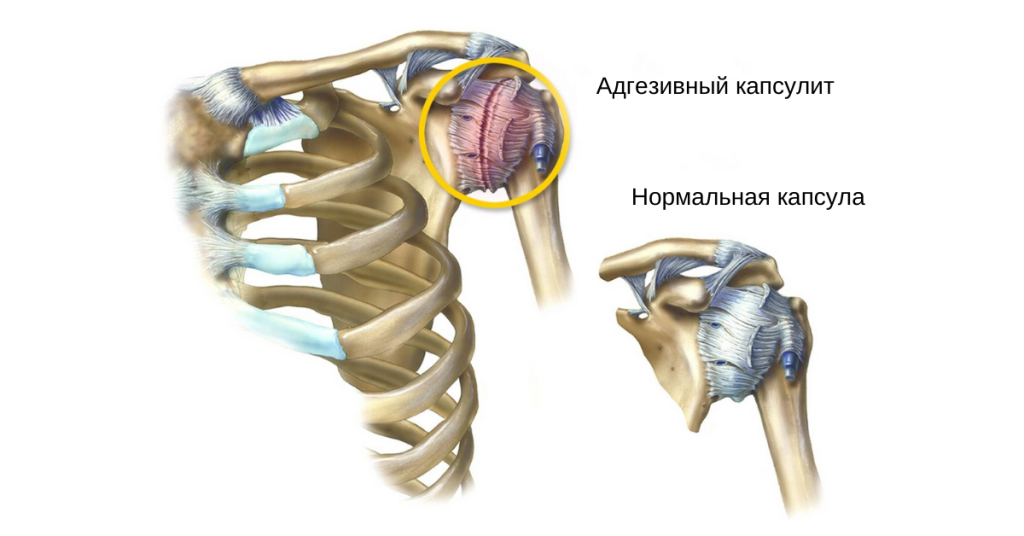
Среди практически всех заболеваний плечевого сустава наибольшие споры вызывает синдром «замороженного плеча» (ЗП), начиная с терминологии и заканчивая наиболее оптимальным лечением и прогнозом. Несмотря на то, что термины синдром ЗП и адгезивный капсулит используются в равной степени, в современных рекомендациях ISAKOS предпочтение отдается термину синдром ЗП, а термин «адгезивный капсулит» рекомендуется не использовать, поскольку в плече-лопаточном суставе отсутствуют спайки (Itoi, 2016). Комитет по верхней конечности ISAKOS классифицирует «тугоподвижное плечо» на первичное идиопатическое тугоподвижное плечо (замороженное плечо) и вторичное тугоподвижное плечо (Itoi, 2016). Термины синдром ЗП или первичное идиопатическое тугоподвижное плечо используются для описания тугоподвижности плеча, развивающейся без какой-либо предшествующей специфической травмы или наличия основного заболевания. У пациента может быть заболевание, о котором известно, что оно связано с тугоподвижностью (диабет, заболевания щитовидной железы), но не обязательно, что оно является причиной тугоподвижности плеча. Термин вторичное тугоподвижное плечо предназначен для описания тугоподвижности плеча, которая патогенетически связана с основной причиной, такой как травма, инфекция или воспалительное заболевание.
Распространенность синдрома ЗП оценивается в 2-5% от общей популяции (Buchbinder, 2004; Shah, 2007), причем мужчины страдают чаще, чем женщины (Hand, 2008). Пик заболеваемости приходится на возраст от 40 до 60 лет (Kingston, 2018). У 20% пациентов аналогичные симптомы могут развиваться в противоположном плече (Hand, 2008; Rizk, 1982). Двустороннее одновременное поражение наблюдается у 14% пациентов (Walker-Bone, 2004).
Сопутствующие заболевания
Первичное ЗП является идиопатическим, но существует два заболевания, которые классически с ним ассоциируются. Это сахарный диабет (СД) и дисфункция щитовидной железы. Частота встречаемости синдрома ЗП у пациентов с сахарным диабетом может варьировать от 10,8 до 30% (Zreik, 2016; Bridgman, 1972) с тенденцией к более выраженным симптомам и резистентности к лечению (Dias, 2005). Распространенность СД в десять раз выше у пациентов с синдромом ЗП, а более высокий уровень HbA1C при плохо контролируемом диабете ассоциируется с развитием синдрома ЗП (Chan, 2017). Несколько исследований подтвердили более высокую распространенность (27,2%) и частоту (10,9%) гипотиреоза у пациентов с синдромом ЗП (Schiefer, 2017; Cakir, 2003). В другом недавнем исследовании риск развития синдрома ЗП у пациентов с тиреопатией был повышен в 2,69 раза (Cohen, 2020). Другими ассоциированными с синдромом ЗП состояниями являются курение, сердечные заболевания, болезнь Паркинсона, инсульт, операции на шее и сердце, гиперлипидемия и контрактура Дюпюитрена (Itoi, 2016; 2011).
Патология
Синдром ЗП характеризуется интенсивными воспалительными изменениями в капсуле, что указывает на роль медиаторов воспаления (интерлейкины, цитокины, В- и Т-лимфоциты, факторы роста, матриксные металлопротеиназы, факторы некроза опухоли и маркеры активации фибробластов) и нарушение локальной трансляции коллагена, приводящее к глобальной фиброплазии (Cher, 2018; Akbar, 2019). Макроскопически капсула при синдроме ЗП выглядит толстой, перегруженной и воспаленной, особенно вокруг ротаторного интервала и передне-нижней части капсулы, а также утолщенной клювовидно-плечевой связкой (КПС) и верхней, средней и нижней суставной-плечевых связок, что приводит к ограничению сгибания, отведения и вращения (Neer, 1992; Ozaki, 1989). В образцах тканей при синдроме ЗП обнаруживается плотный коллагеновый матрикс и высокая популяция фибробластов и сократительных миофибробластов, что напоминает контрактуру Дюпюитрена, причем фиброзный процесс ограничивается преимущественно передней частью капсулы (Kilian, 2007; Lho, 2013). В начале каскада воспалительных изменений наблюдается ранний иммунный ответ с повышением уровня аларминов, связыванием с рецептором конечных продуктов гликозилирования и накоплением необратимых «сшивок» между различными молекулами коллагеновых белков за счет гликозилирования (Kraal, 2020; Kohn, 1977). Также отмечается повышенная экспрессия факторов роста эндотелия сосудов (особенно у больных СД с высоким уровнем гликозилированного гемоглобина), рецепторов фактора роста нервов и неоангиогенеза, что может объяснить сильную боль и скованность у пациентов с синдромом ЗП (Xu, 2012; Ryu, 2006). Таким образом, синдром ЗП, по-видимому, начинается как воспалительная реакция в капсуле с сопутствующим синовитом, который прогрессирует до фиброзной контрактуры капсулы.
Клинические особенности и клинико-патологические стадии
Пациенты с синдромом ЗП жалуются на внезапное появление боли и скованности без каких-либо предшествующих травматических, инфекционных или воспалительных событий. Боль обычно слабо локализована, вокруг плеча и почти всегда беспокоит в ночное время, когда пациент лежит на пораженной стороне. При осмотре плеча выявляется глобальное ограничение как активной, так и пассивной амплитуды движений как минимум в двух плоскостях, что является одним из критических признаков. Уменьшение наружной ротации при прижатии локтя к грудной клетке является одним из самых ранних признаков заболевания. Согласно рекомендациям ISAKOS, если амплитуда движений плеча составляет менее 100 градусов при флексии, менее 10 градусов при наружной ротации и менее уровня L5 позвонка при внутренней ротации, то это определяется как глобальное ограничение амплитуды движений (Itoi, 2016). В недавно опубликованном исследовании FROST исследователи определили синдром ЗП как состояние, характеризующееся ограничением амплитуды пассивной наружной ротации в пораженном плече (на 50% менее, чем в противоположном плече) при нормальных рентгенограммах (Rangan, 2020). Сила мышц ротаторной манжеты при этом относительно не нарушается.
Традиционно синдром ЗП описывается в виде трех клинико-патологических стадий (замораживание, замороженность и размораживание), что удобно для объяснения пациентам и принятия решения о плане лечения (Neviaser, 1987; Reeves, 1975). Другая классификация, предложенная Hanchard и соавт.: «с преобладанием боли» и «с преобладанием скованности», также полезна в клинической практике (Hanchard, 2012).
Основными клиническими характеристиками трех стадий являются боль, боль и скованность, скованность соответственно.
- Стадия замораживания (стадия 1). Она может длиться 2-6 месяцев. Клинически 1-я стадия характеризуется преимущественно умеренно выраженной болью и частичным ограничением амплитуды движений. Патоморфологически она характеризуется медленным развитием распространенного воспаления с вовлечением капсулы и синовии плече-лопаточного сустава, что приводит к постепенному появлению болевого синдрома (как основного симптома). Боль и некоторое уменьшение подвижности в конце амплитуды движений в раннем периоде стадии замораживания можно спутать с тендинопатией ротаторной манжеты, поскольку последняя также характеризуется болью и уменьшением подвижности в конце амплитуды. Однако при тендинопатии не происходит прогрессирующего уменьшения амплитуды, в то время как при синдроме ЗП это наблюдается при каждой последующей оценке.
- Стадия замороженности (стадия 2). Она может длиться 4-12 месяцев. Клинически эта стадия характеризуется наличием боли и скованности, выраженных в различных пропорциях. Пациенты, находящиеся в самом начале 2-й стадии, больше страдают от боли, в то время как в конце 2-й стадии — от скованности (ограничения амплитуды движений). Патоморфологически это характеризуется постепенным уменьшением воспаления и появлением распространенного фиброза капсулы и связок, что приводит к выраженному ограничению амплитуды движений.
- Стадия размораживания (стадия 3). Она может длиться 6-26 месяцев. Клинически эта стадия характеризуется минимальной болью и постепенным уменьшением скованности. Патоморфологически она характеризуется постепенным разрешением воспаления и фиброза, что приводит к уменьшению боли и постепенному восстановлению объема движений.
Исследования
Взаимосвязь между установленным СД и дисфункцией щитовидной железы с синдром ЗП является общеизвестным фактом, однако доказательств необходимости обследования внешне «нормогликемического пациента с синдром ЗП» с определением уровня глюкозы крови натощак и гемоглобина A1C становится все больше, поскольку в ряде исследований было подтверждено, что эти два показателя часто нарушены у пациентов синдром ЗП (Chan, 2017; Rai, 2019; Ramirez, 2019. Кроме того, при наличии клинических подозрений следует также обследовать пациента на предмет дисфункции щитовидной железы (Schiefer, 2017). Первичное замороженное плечо — это, по сути, клинический диагноз, поэтому рентгенографические исследования проводятся для исключения других вторичных причин боли в плече, таких как кальцифицирующая тендинопатия, повреждение ротаторной манжеты, артрит плече-лопаточного и акромиально-ключичного суставов или неопластический процесс. Обычная рентгенограмма плеча у пациентов с синдромом ЗП в основном нормальная. Однако нередко встречается остеопения головки плечевой кости, которая должна насторожить врача (Okamura, 1999). МРТ у пациентов с синдромом ЗП обычно не проводится. Однако при наличии клинических подозрений она может быть выполнена для исключения вторичных причи. На ранней стадии замораживания МРТ может показать отек капсулы сустава и облитерацию подклювовидного жирового треугольника. В стадии замороженности МРТ показывает утолщение капсулы и КПС, уменьшение объема подмышечной сумки и образование рубцов в ротаторном интервале (Fields, 2019). В последнее время для установки диагноза «синдром ЗП» в качестве основного диагностического инструмента используется ультразвуковое исследование (УЗИ), которое выявляет утолщение КПС (средняя толщина 1,2 мм, наблюдается в 96,7% случаев), повышенную васкуляризацию и наличие гипоэхогенной толщины мягких тканей в ротаторном интервале и наличие гипоэхогенной толщины мягких тканей (Tandon, 2017).
Лечение
В целом консервативное лечение ЗП успешно у 90% пациентов (Levine, 2007; Redler, 2019). Лишь некоторым из них требуется оперативное вмешательство в виде манипуляции под анестезией (МПА) или артроскопического релиза капсулы (АРК). В клинической практике выбор стратегии лечения часто зависит от клинико-патологической стадии. Кроме того, пациенты с синдромом ЗП должны лечиться от сопутствующих заболеваний (СД и дисфункции щитовидной железы), поскольку плохой контроль этих заболеваний может привести к ухудшению течения заболевания. Несмотря на то, что у больных сахарным диабетом заболевание протекает тяжело, требует длительного консервативного лечения и чаще, чем у недиабетиков, заканчивается операцией (Wang, 2010; Erickson, 2019), не следует отказываться от попыток консервативного лечения и сразу переходить к хирургическому лечению.
- Стадия замораживания. Поскольку эта стадия характеризуется наличием интенсивной боли, обусловленной воспалением капсульно-связочного аппарата, стратегия лечения на этой стадии должна быть направлена на минимизацию боли. Для уменьшения боли используется множество средств, таких как прием НПВС, стероидов (местных или пероральных), а также «обезболивающая» физическая терапия. Необходимо подчеркнуть, что ни одна из этих мер не снимет боль полностью, и вся работа по минимизации боли направлена на то, чтобы пациент мог легче выполнять повседневную деятельность, лучше спать и постепенно увеличивать мобильность сустава. Мобилизационная терапия в основном направлена на сохранение и «медленное восстановление» амплитуды движений. Следует отметить, что в период сильной боли следует избегать интенсивной мобилизации, так как она может усилить воспаление и привести к увеличению интенсивности боли.
- Стадия замороженности. На этой стадии боль меньше, но уменьшение амплитуды движение достаточно выраженное из-за фиброза капсульно-связочного комплекса. Поэтому стратегия лечения должна быть направлена в первую очередь на постепенное «увеличение и восстановление» объема движений путем проведения структурированной и последовательной программы мобилизационной терапии. Гидродилатация (ГД) также может быть использована в качестве вспомогательного средства вначале стадии замородженности для разрушения капсульного фиброза и ускорения восстановления амплитуды движений. Показан эпизодический прием анальгетиков. Если физическая терапия в течение нескольких недель-месяцев и ГД не увеличивают функциональную амплитуду и не снижают уровень боли, то для ускорения функционального восстановления в плане восстановления амплитуды движений и минимизации боли можно рассмотреть МПА или АРК.
- Стадия размораживания. Эта стадия характеризуется минимальной болью или ее отсутствием и постепенным восстановлением амплитуды движений. Поэтому основным методом лечения на этой стадии остается лечебная физкультура, направленная на постепенное восстановление функциональности и последующее полное восстановление объема движений плеча. Хирургические вмешательства на этой стадии практически не требуются.
Неоперативное лечение при синдроме замороженного плеча
- НПВС и другие анальгетики. Прием НПВС остается одним из наиболее распространенных видов медицинского вмешательства при лечении синдрома ЗП (Tasto, 2007). Для уменьшения боли на стадии замораживания обычно назначают НПВС в течение 2-3 недель. Курс приема НПВС не меняет течение заболевания, но позволяет пациенту спокойнее выполнять повседневные дела и лечебные упражнения. Однако существует недостаток высококачественных исследований, в которых обсуждаются преимущества НПВС по сравнению с другими препаратами, особенно кортикостероидами. У пациентов с аллергией или противопоказаниями к применению НПВС можно использовать опиоидные анальгетики.
- Кортикостероиды. Наряду с НПВС для лечения синдрома ЗП могут применяться стероиды. Они являются вторыми по частоте применения препаратами. Широко используются как пероральные стероиды, так и локальные инъекции стероидов. Важно отметить, что стероиды в любой форме полезны только на ранних стадиях (стадия замораживания и начало стадии замороженности) ЗП для контроля воспаления и боли, а на поздних стадиях с установленным фиброзом и без сильного воспаления назначать их нецелесообразно.
- Пероральные стероиды. В нескольких высококачественных исследованиях были получены умеренные доказательства в пользу приема пероральных стероидов (в плане уменьшения боли, увеличения амплитуды движений и восстановления функции) при назначении на «короткий срок» (6 недель) на 1-й стадии (Favejee, 2011; Buchbinder, 2006). Однако этот эффект не сохранялся более 6 недель после прекращения приема. Тем не менее следует опасаться такого осложнения, как аваскулярный некроз головки плечевой кости, даже при коротком курсе приема пероральных стероидов (McKee, 2001).
- Локальные инъекции стероидов. Это наиболее часто применяемый вариант для купирования сильной боли в стадии замораживания. Систематические обзоры и мета-анализы подтвердили убедительные доказательства в пользу инъекций стероидов (в плане уменьшения боли и увеличения амплитуды) по сравнению с плацебо в краткосрочной перспективе и умеренные доказательства в среднесрочной перспективе (Favejee, 2011; Wang, 2017). В двух рандомизированных контролируемых исследованиях был сделан вывод о том, что инъекционные стероиды дают более высокие клинические результаты по сравнению с пероральными (Widiastuti-Samekto, 2004; Lorbach, 2010). Инъекция стероидов, безусловно, превосходит физическую терапию в плане уменьшении боли, но данные о восстановлении амплитуды движений противоречивы при сравнении инъекций стероидов с физической терапией или МПА (Favejee, 2011).
- Кроме того, многие вопросы, касающиеся применения местных инъекционных стероидов, такие как оптимальная доза (Kim, 2018; Yoon, 2013), однократность или многократность введения, место введения (внутрисуставное/субакромиальное/ротаторный интервал) (Shang, 2019; Sun, 2018), молекула (триамцинолон/метилпреднизолон) (Choudhary, 2015; Chávez-López, 2008), введение с визуализацией или без нее (Song, 2014), остаются спорными.
- Следует отметить, что инъекции стероидов сопряжены с риском преходящего повышения уровня глюкозы в крови в течение 1-5 дней у пациентов с сахарным диабетом (Waterbrook, 2017). Однако повышение уровня глюкозы возвращается к исходному уровню в течение 24ч — 10 дней, и польза от инъекций стероидов в плане улучшения болевого синдрома и функциональных показателей перевешивает любое преходящее повышение уровня глюкозы. Тем не менее, следует избегать инъекций стероидов у пациентов с неконтролируемым диабетом, особенно если уровень ЛПНП превышает 250мг%.
- Нежелательные явления при использовании инъекционных стероидов. Сообщалось о таких незначительных осложнениях, как гиперемия лица, боль в груди или плече, головокружение и тошнота, обусловленные вазовагальными реакциями при инъекциях (Sun, 2017). Кроме того, следует избегать инъекций триамцинолона у пациентов, получающих ретровирусную терапию, из-за риска лекарственного взаимодействия, вызывающего ятрогенный синдром Кушинга (Xiao, 2017).
- Физическая терапия. Наряду с НПВП и стероидами, физическая терапия остается одним из краеугольных камней в лечении «синдрома ЗП. Физическая терапия включает в себя «обезболивающую», «мобилизационную» и «укрепляющую» составляющие. На стадии замораживания лучше использовать обезболивающую терапию и избегать агрессивных методов мобилизации, так как они могут усилить боль. Существуют различные методы обезболивающей терапии, такие как лазер, коротковолновая диатермия, ультразвук и горячие пакеты (Favejee, 2011; Page, 2014). Лечебная физкультура в сочетании с НПВС или инъекциями стероидов лучше снимает симптоматику, чем только лечебная физкультура (Dudkiewicz, 2004; Chan, 2017).
После уменьшения боли можно приступать к «мобилизационной терапии» для сохранения и постепенного восстановления амплитуды движений. Таким пациентам необходимо начинать с 3-4 занятий в день, каждое из которых длится 10-15 мин и включает в себя активные упражнения для восстановления объема движений, в том числе сгибание, отведение, ротацию и горизонтальное приведение. Эти упражнения должны сочетаться с упражнениями для лопатки и ротаторной манжеты, а также с укреплением мышц кора. Grigg’s и соавт. подтвердили, что пациенты на II стадии ЗП отмечают высокий эффект упражнений на растяжку в четырех направлениях (Griggs, 2000). На поздней стадии ЗП для восстановления амплитуды движений могут применяться низко- и высокопороговые методы мобилизации, а также укрепляющие упражнения (Favejee, 2011).
При сравнении физической терапии с МПА в стадии замороженности высококачественное рандомизированное контролируемое исследование подтвердило превосходство МПА над одними только домашними упражнениями (Kivimäki, 2007).
- Гидродилатация (ГД). Вначале и в конце стадии замороженности гидродилатация плече-лопаточного сустава с использованием физраствора, стероидов и местных анестетиков должна привести к растяжению капсулы за счет разрушения «раннего внутрикапсульного фиброза». Естественно, это способствует улучшению амплитуды движений (Buchbinder, 2004). Однократная процедура ГД превосходит плацебо по увеличению амплитуды, уменьшению боли и восстановлению функции в краткосрочной перспективе (Buchbinder, 2004). Однако более чем однократное повторение ГД через 2 недели не дает дополнительного эффекта по сравнению с однократной процедурой (Piotte, 2004). Тем не менее, ГД не дает никаких преимуществ по сравнению с инъекциями стероидов (Paruthikunnan, 2020; Saltychev, 2018).
- Кальцитонин уменьшает системную воспалительную реакцию и стимулирует высвобождение эндорфинов (Sahin, 2006). Yang и соавт. подтвердили, что добавление кальцитонина лосося в биопсированные ткани замороженного плеча улучшает экспрессию мРНК молекул, связанных с фиброзом, и снижает повышенную способность клеток-субстратов к адгезии в замороженном плече (Yang, 2020). В рандомизированном контролируемом исследовании II уровня был сделан вывод о том, что добавление кальцитонина вместе с физической терапией и НПВС уменьшает боль и улучшает функцию, чем просто физическая терапия и НПВС (Sahin, 2006). Однако для подтверждения роли кальцитонина в лечении ЗП необходимы дальнейшие исследования.
- Экстракорпоральная ударно-волновая терапия (ЭУВТ). Исследования с участием 40 пациентов, получавших ЭУВТ в сравнении с пероральными стероидами, подтвердило, что ЭУВТ значительно улучшает функциональный результат и амплитуду движений без каких-либо побочных явлений (Chen, 2014). В систематическом обзоре 19 исследований (1249 пациентов) было показано, что применение ЭУВТ не привело к каким-либо серьезным побочным эффектам (Page, 2014). Кроме того, ЭУВТ является подходящей альтернативой для пациентов с неконтролируемым диабетом или при невозможности назначения пероральных стероидов.
- Акупунктура. Несмотря на то, что несколько центров пытались использовать акупунктуру в лечении синдрома ЗП и сообщали об умеренном уменьшении боли и улучшении флексии (Ben-Arie, 2020; Lo, 2020), в литературе мало данных в пользу ее рутинного применения в лечении первичного синдрома ЗП (Rangan, 2016).
- Блокада нерва. Некоторые авторы сообщают, что однократная или многократная блокада супраскапулярного нерва при лечении синдрома ЗП приводит к улучшению показателей по боли и амплитуде (Mortada, 2017; Ozkan, 2012). Однако высококачественные доказательства в пользу блокады нерва отсутствуют, и в рутинном порядке она не проводится.
Оперативное лечение при синдроме замороженного плеча
Инвазивные оперативные методы лечения (манипуляции или хирургический релиз капсулы) у пациентов с первичным ЗП рекомендуются только в тех случаях, когда длительное консервативное лечение в течение 6-9 месяцев не приносит существенного улучшения (Karas, 2016; Ramirez, 2019; Redler, 2019). Хирургические методы включают в себя манипуляцию под анестезией (МПА) и артроскопический релиз капсулы (АРК).
Манипуляции под анестезией — это метод, при котором фиброзированный капсульно-связочный комплекс плеча, который является препятствием для восстановления нормальной амплитуды движений, принудительно разрывается путем активной мобилизации плеча. Krall и др. (2019) высказали предположение, что МПА является эффективным методом улучшения функции плеча у пациентов с рефрактерным ЗП во II стадии, с наружной ротацией <50% по сравнению с противоположной стороной и неспособностью реагировать на внутрисуставное введение стероидов. Примечание: МПА не следует выполнять при вторичной тугоподвижности плеча — таким пациентам при необходимости необходимо выполнить артроскопический релиз капсулы (АРК).
Техника выполнения: Под анестезией руку пациента удерживают коротким рычагом и осторожно перемещают плечо во флексию, абдукцию с последующей наружной и внутренней ротацией (в абдукции на 90 градусов). Далее плечевой сустав приводится в положение наружной ротации с горизонтальным приведением руки. Эти маневры приводят к разрыву фиброзированной ткани, что часто можно почувствовать или услышать во время МПА. Следует отметить, что ни одно движение не должно выполняться форсировано, если по ходу движения ощущается избыточное сопротивление, то во избежание осложнений лучше выполнить следующий маневр, а не прилагать слишком большое усилие для восстановления именно этого движения. В конце процедуры все движения повторяются, чтобы удостовериться, что конечная амплитуда достигнута. Авторы предпочитают вводить 40 мг Триамцинолона и 10 мл 0,25% раствора Бупивакаина, чтобы свести к минимуму риск возникновения послеоперационной боли и воспаления. Многие другие авторы также предпочитают вводить после МПА стероиды и местные анестетики (Kivimäki, 2001; Lee, 2020). Однако явные доказательства их пользы отсутствуют. Во многих исследованиях сообщалось о хороших или превосходных долгосрочных клинических результатах после МПА (Farrell, 2005; Thomas, 2011). Said считает, что имеется несколько спорных вопросов, касающихся МПА, таких как сроки восстановления (Vastamäki, 2015), необходимость инъекции стероидов (Kivimäki, 2001), эффективность МПА по сравнению с другими консервативными вариантами лечения (Kivimäki, 2007; Jacobs, 2009) и эффективность МПА у диабетиков (Wang, 2010; Hamdan, 2003; Woods, 2017).
Осложнения МПА: В литературе сообщается, что общая частота осложнений составляет 0,4%, а частота повторного вмешательства — 14% (Kraal, 2019). Хотя МПА улучшает сгибание и отведение, ограничение ротации после МПА остается проблемой, поскольку хирурги часто избегают принудительных вращений плеча во время МПА из-за боязни осложнений. Хотя и редко, во время МПА могут возникать различные осложнения, особенно при достижении конечной амплитуды движений. Сюда относятся: перелом плечевой кости, разрыв ротаторной манжеты, вывих плеча, разрыв суставной губы, повреждение нервов и комплексный регионарный болевой синдром (Hamdan, 2003; Magnussen, 2011; Nunez, 2016).
Артроскопический релиз капсулы. Хотя все высококачественные клинические исследования не выявили каких-либо существенных преимуществ АРК перед МПА (Rangan, 2020; Grant, 2013), в последнее время АРК стал предпочтительным хирургическим вариантом лечения рефрактерного ЗП, поскольку АРК позволяет контролируемо и точно высвобождать фиброзированный капсульно–связочный комплекс под визуальным контролем, избегая указанных выше осложнений МПА при той же анестезиологической нагрузке (Redler, 2019; Miyazaki, 2017). Кроме того, АРК позволяет хирургу тщательно осмотреть и вылечить «клинически или рентгенологически пропущенное» сопутствующее поражение хряща, вращательной манжеты, верхней части суставной губы и субакромиального пространства, если таковые имеются, поскольку они могут способствовать развитию патологии. Как и МПА, АРК следует проводить между 6 и 8 месяцами от начала заболевания.
Многие исследования показали отличные краткосрочные, средне- и долгосрочные результаты как с точки зрения длительного уменьшения боли, так и увеличения амплитуды движений при применении АРК (Cvetanovich, 2018; Forsythe, 2020). При этом, сравнивая диабетиков с недиабетиками, ученые пришли к выводу, что клинические исходы после АРК были хуже у пациентов с сахарным диабетом по сравнению с недиабетиками (больше случаев остаточной боли, снижение подвижности). И это необходимо объяснить пациенту во время консультирования перед АРК (Boutefnouchet, 2019).
Техника выполнения: Диагностическая артроскопия проводится под анестезией из заднего доступа. Проникновение в сустав часто бывает сложным, и при введении троакара необходимо соблюдать осторожность, чтобы избежать повреждения суставного хряща плечевой кости или суставной впадины лопатки. В случае, если проникновение в сустав невозможно, необходимо избегать применения силы и провести с суставом мягкие, контролируемые манипуляции, чтобы разорвать чрезвычайно плотную капсулу, что позволило бы хирургу ввести артроскоп. Lafosse и др. (2012) рекомендует боковой ввод через ротаторный интервал, чтобы избежать повреждения внутрисуставных структур. Почти во всех случаях ротаторный интервал сокращен и воспален, во внутрисуставной части сухожилия двуглавой мышцы может быть обнаружено воспаление, а в суставе часто присутствует синовит, особенно над капсулой, которую покрывают над- и подостная мышцы. Через стандартный передний доступ с помощью радиочастотного устройства высвобождается клювовидно-плечевая связка и синовит аккуратно удаляется. Осуществляется релиз средней плече-лопаточной связки с последующим высвобождением передней части капсулы (до передне-нижнего угла). Затем прицел смещают к переднему доступу, а заднюю часть капсулы освобождают до задне-нижнего угла. Из-за близости нижней части капсулы к подмышечному нерву самая нижняя часть капсулы не освобождается хирургическим путем, а разрывается с помощью МПА в конце процедуры (Ogilvie-Harris, 1986). Относительно клинического исхода после ограниченного высвобождения передней части капсулы и МПА в сравнении с периферическим высвобождением данные литературы остаются спорными (Redler, 2019). Затем артроскоп перемещают в субакромиальное пространство и удаляют субакромиальную спайку или воспаленную бурсу, если таковая имеется. С помощью артроскопа, введенного через латеральный доступ, клювовидно-плечевая связка снова осматривается и, если обнаруживается неполное ее высвобождение, она должна быть полностью освобождена. Кроме того, спайки на «бурсальной» и «суставной» стороне подлопаточной мышцы высвобождаются до основания клювовидного отростка, чтобы улучшить подвижность подлопаточной мышцы и, таким образом, улучшить наружную ротацию. В конце процедуры хирург должен осторожно подвигать плечом во всех направлениях, чтобы убедиться, что весь фиброзно–капсульно-связочный комплекс высвобожден (Redler, 2019). После МПА или АРК авторы предпочитают вводить 40 мг Триамцинолона вместе с 10 мл 0,25% Бупивакаина, чтобы свести к минимуму риск возникновения воспаления и боли в послеоперационном периоде. Хотя многие авторы предпочитают вводить стероиды после АРК (S-J, 2020; Smith, 2014), лишь немногие сообщают о хороших результатах после инъекции (Hagiwara, 2015). Однако консенсуса относительно полезности инъекции стероидов после АРК нет.
Обезболивание и реабилитация после МПА или АРК: адекватное обезболивание в течение первых 2-3 недель является основным условием для восстановления (для этого можно использовать НПВС и пакеты со льдом). Физическая терапия должна начинаться сразу после МПА или АРК и продолжаться в течение 4-6 месяцев с целью сохранения интраоперационно восстановленной амплитуды движений. Программа лечения должна состоять из раннего пассивного и активного восстановления амплитуды движений со стабилизацией лопатки, затем следует переходить к активному восстановлению амплитуды движений в сочетании с укрепляющими упражнениями для ротаторной манжеты, других периартикулярных мышц и мышц кора.
МПА или АРК: Несмотря на все указанные преимущества АРК перед МПА, в литературе нет данных о превосходство АРК над МПА (Rangan, 2020; S-J, 2020; Grant, 2013). В недавно опубликованном исследовании Rangan (2020) был сделан вывод о том, что физическая терапия, МПА и АРК не превосходят друг друга в лечении резистентного ЗП.
Заключение
При лечении ЗП врач должен лечить сопутствующие заболевания, особенно диабет и дисфункцию щитовидной железы. Ультразвуковую диагностику можно рассматривать в качестве основного инструмента для подтверждения диагноза ЗП и исключения вторичных заболеваний (а не сразу направлять пациента на МРТ). У большинства пациентов с ЗП комбинация консервативных методов лечения дает хорошие или отличные результаты, и прежде чем приступать к инвазивным процедурам, необходимо попробовать их в течение не менее 6-9 месяцев. Тем не менее, ни один из вариантов консервативного лечения не является однозначно лучшим по сравнению с другими, и мультимодальная терапия, включающая НПВС, стероиды и физическую терапию, остается фаворитом на протяжении всего курса лечения. Среди инвазивных процедур, как МПА, так и АРК, по-видимому, не дают однозначного результата в достижении функционального улучшения, но последний вариант в настоящее время является более предпочтительным, поскольку он в значительной степени лишен большинства осложнений, характерных для МПА. Для полного выздоровления в послеоперационном периоде крайне важна ранняя и продолжительная физическая реабилитация, а также хорошее обезболивание. Что касается общего восстановления и достижения удовлетворительных функциональных результатов, то пациенты с сахарным диабетом продолжают оставаться в худшем положении по сравнению с недиабетиками.
Источник: Clinical Guidelines in the Management of Frozen Shoulder.