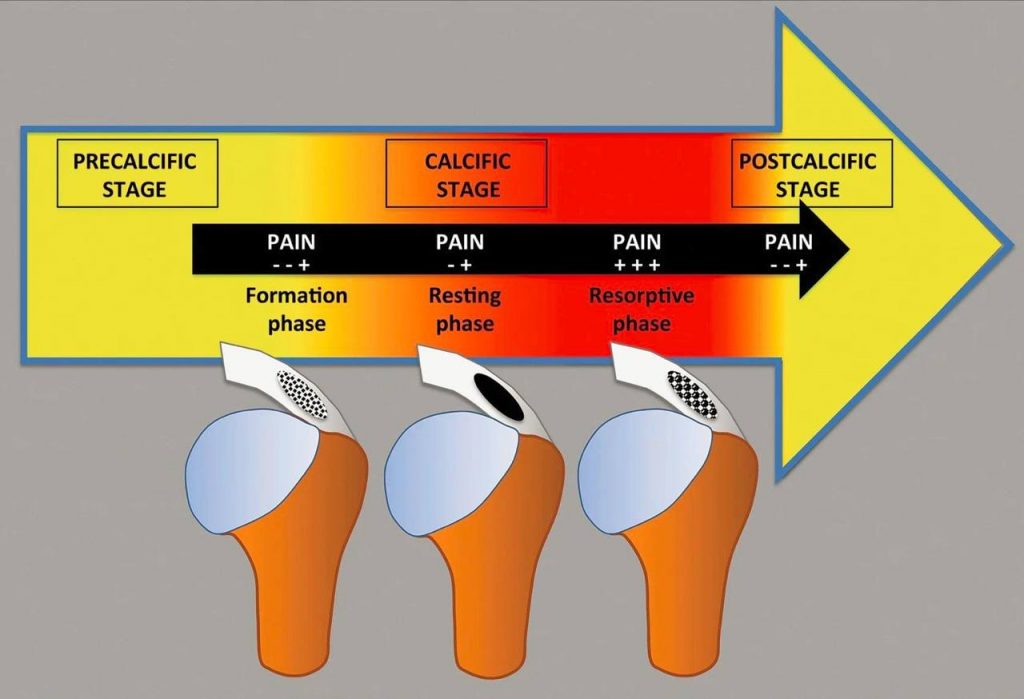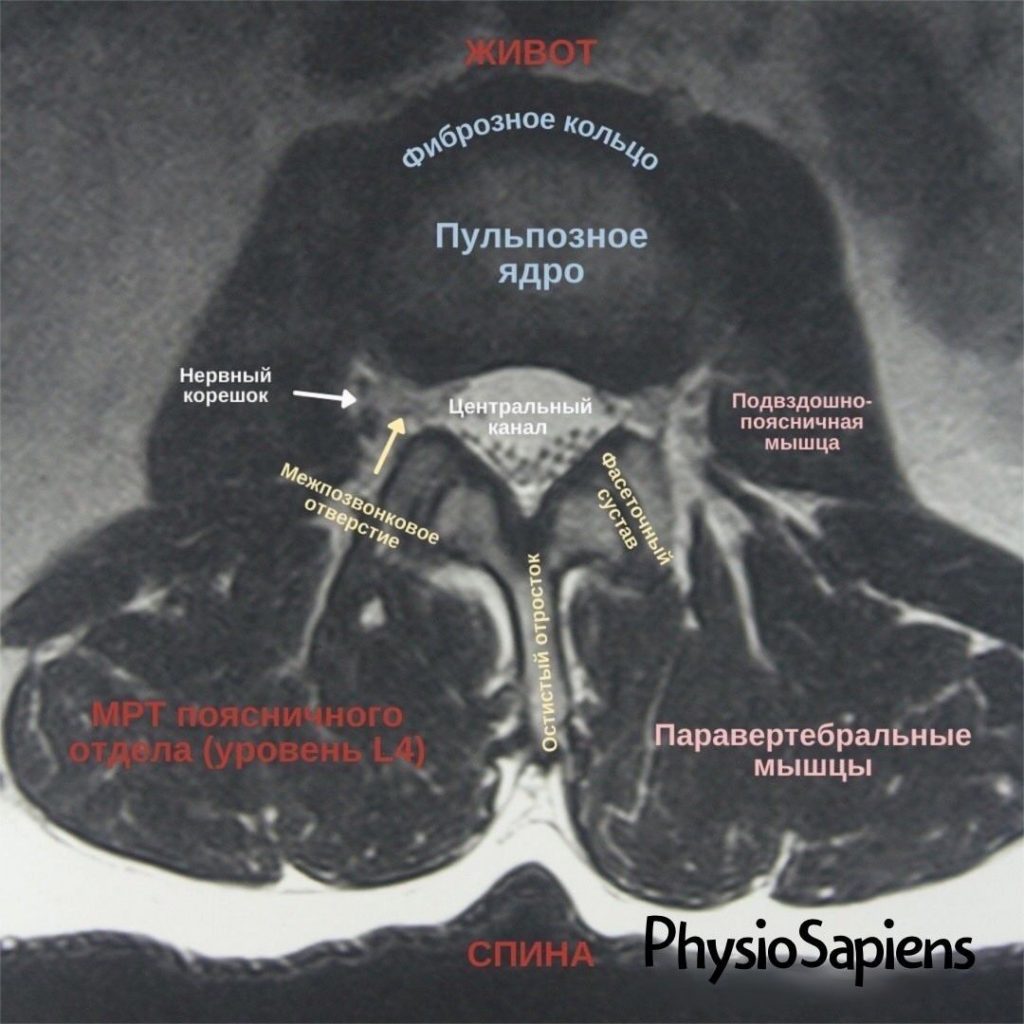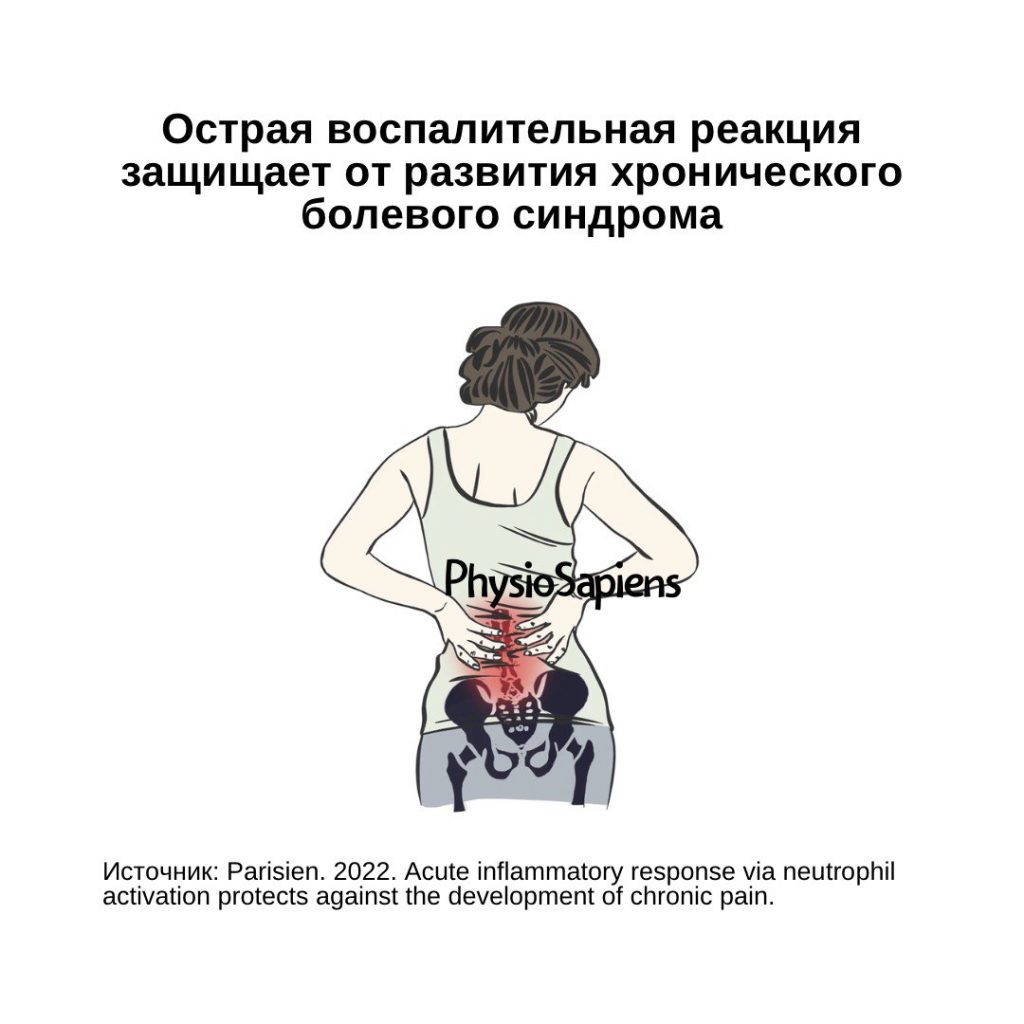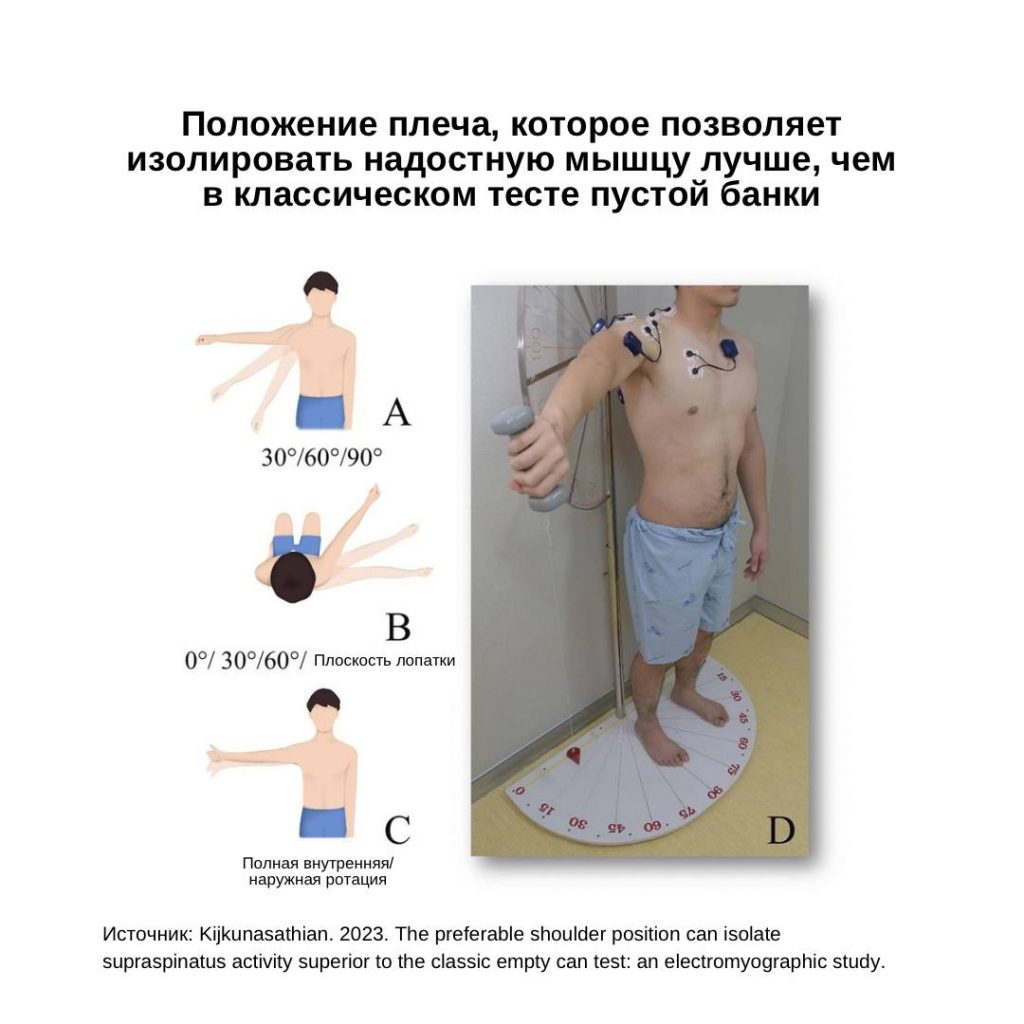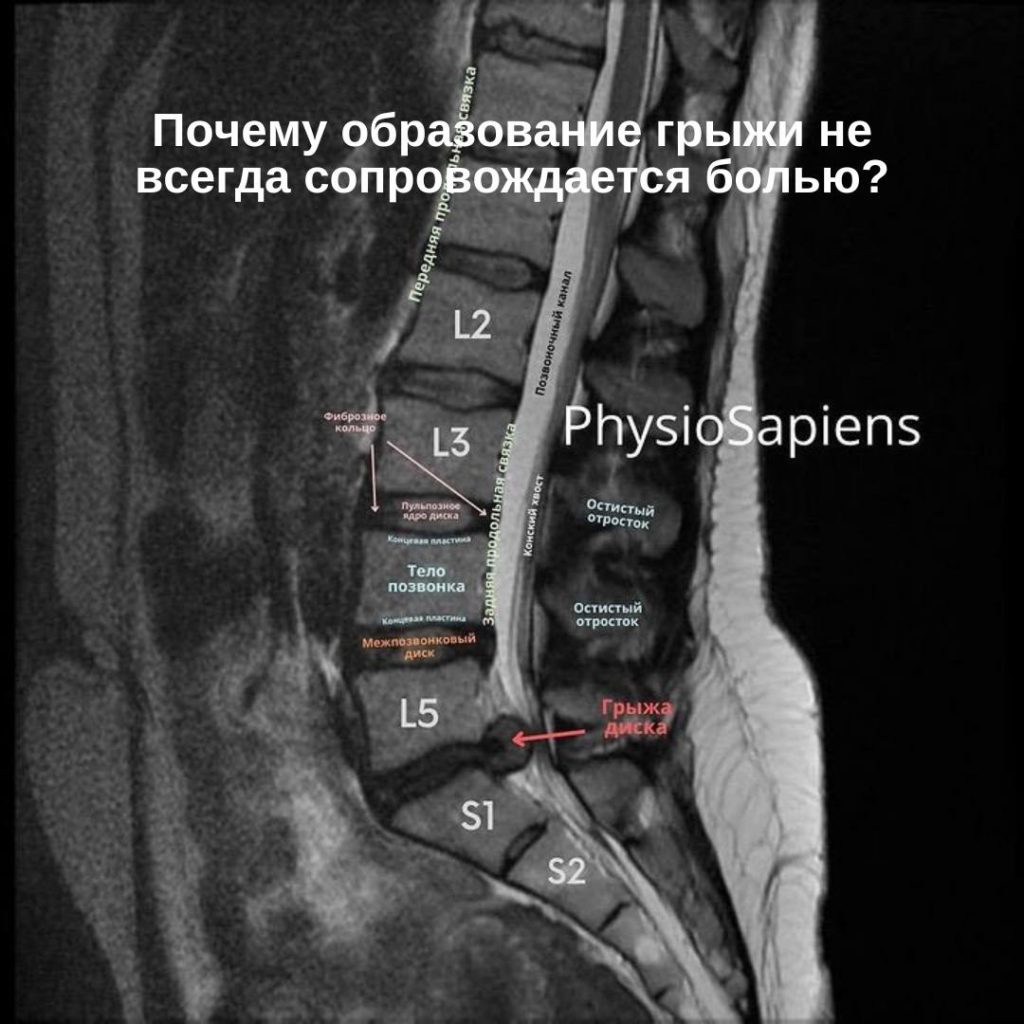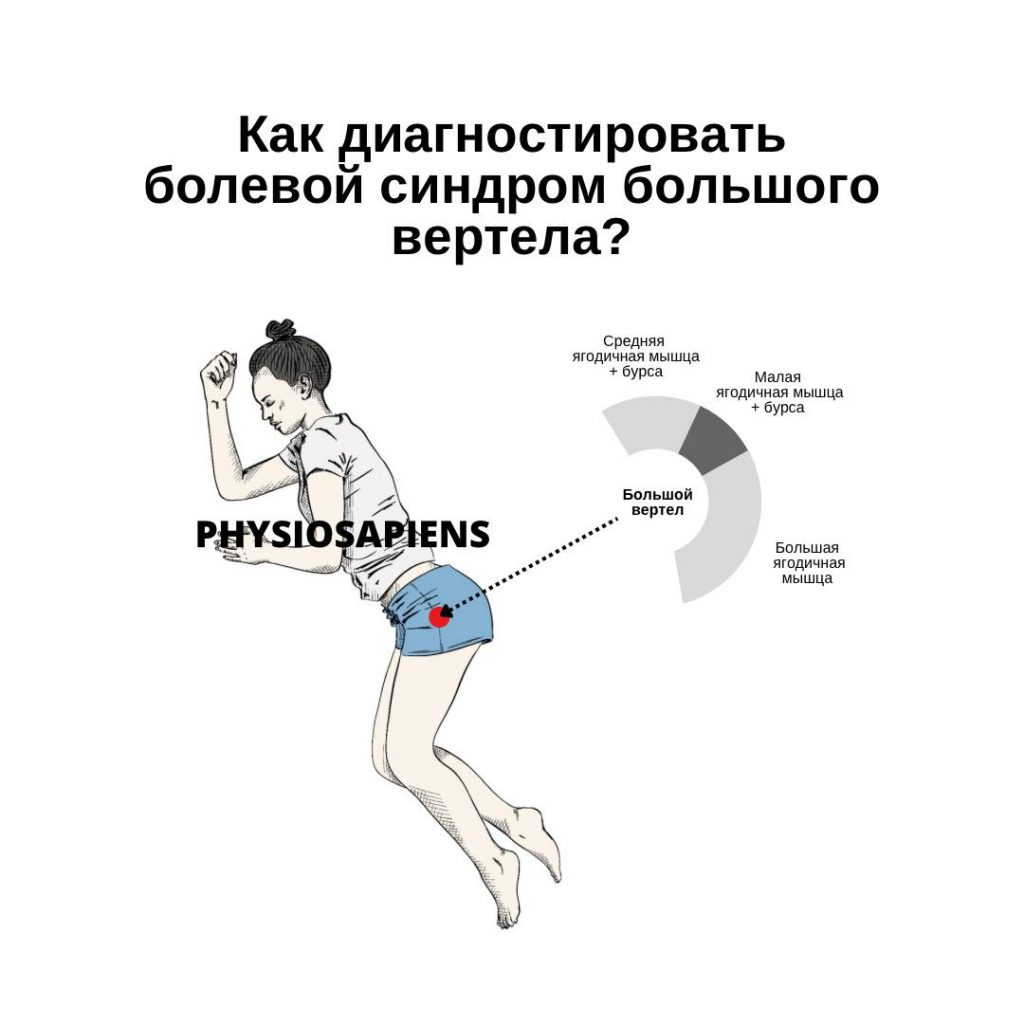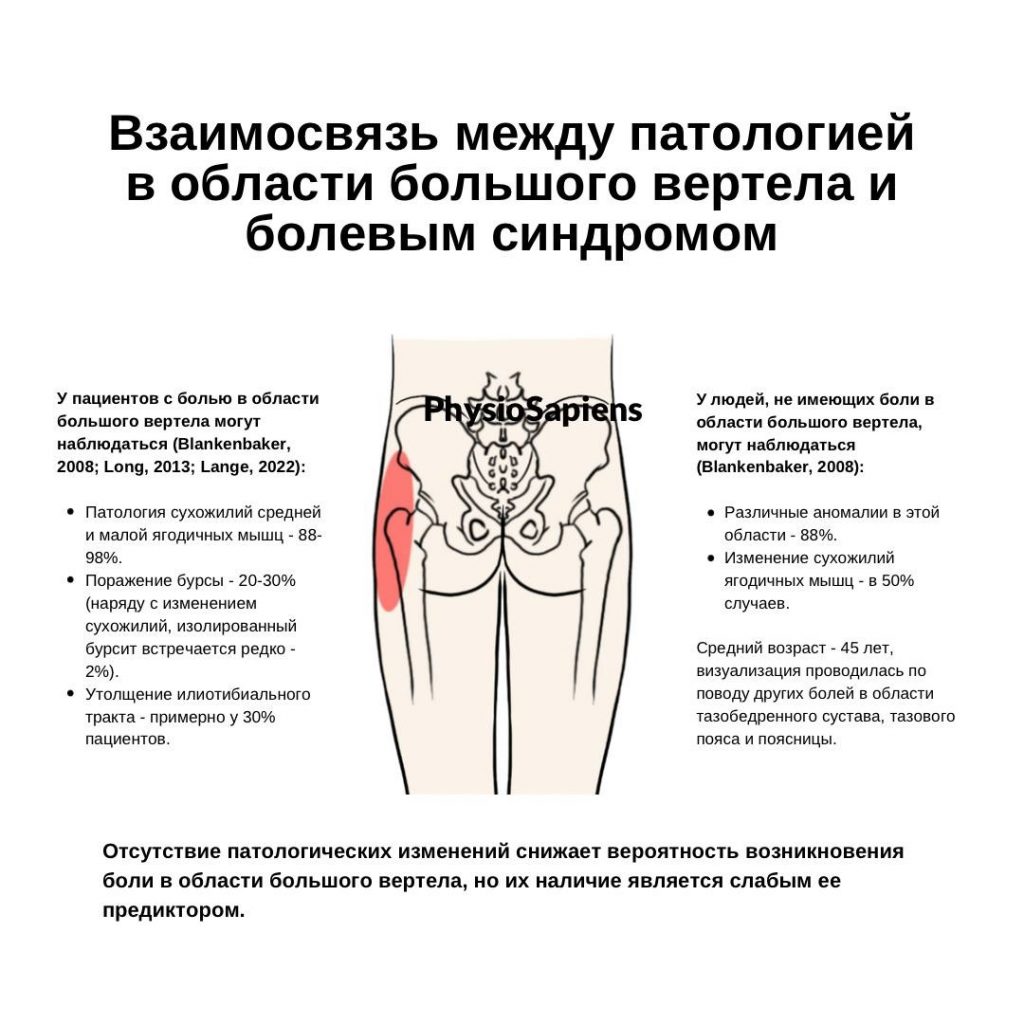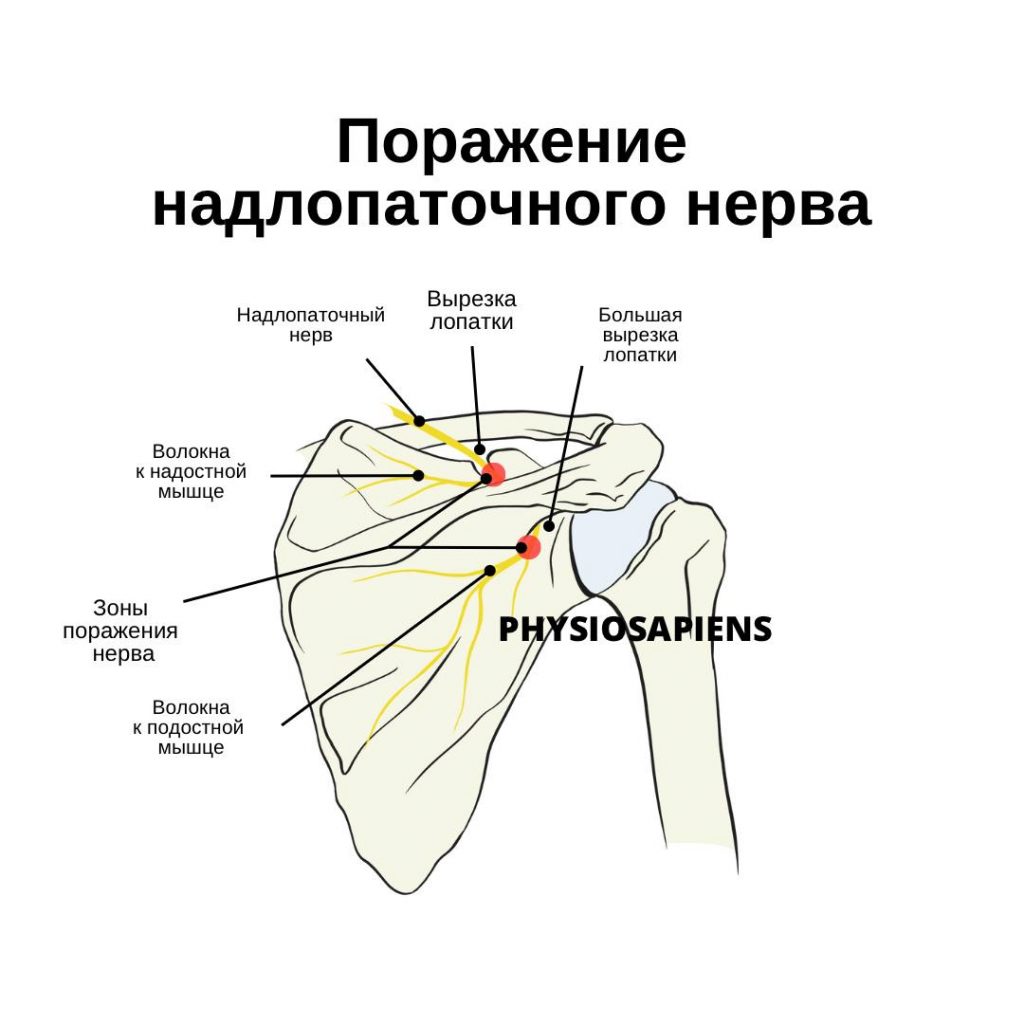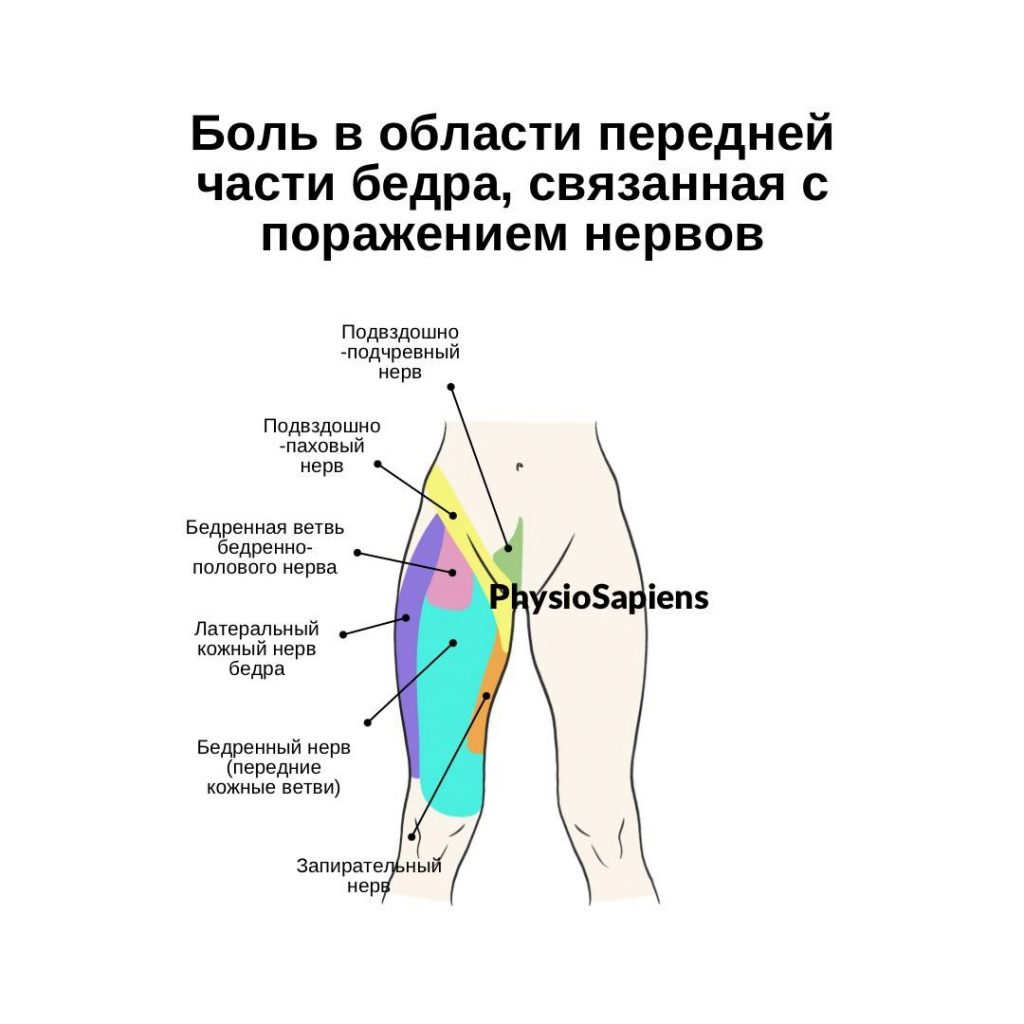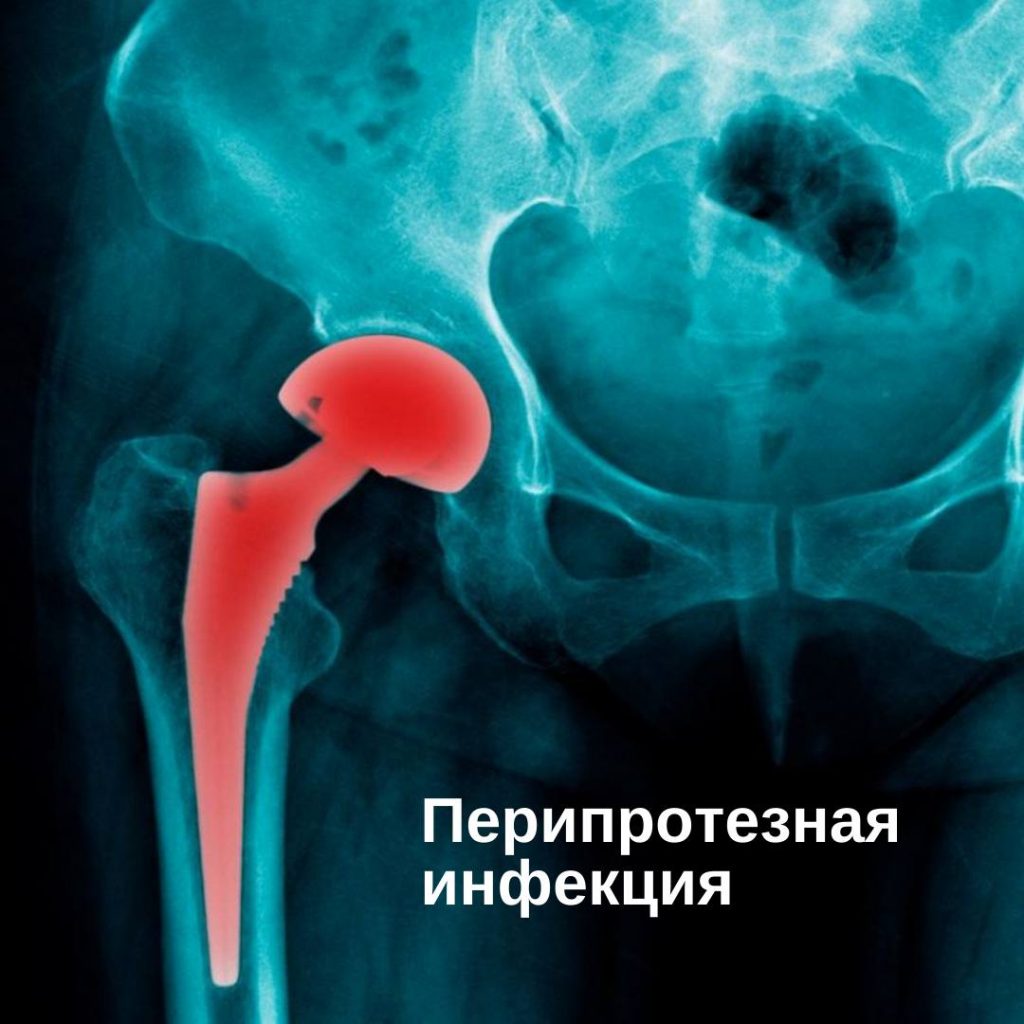
Имплант-ассоциированная инфекция или перипротезная инфекция (ПИ), является редким заболеванием и клинически несколько отличается от обычной инфекции костей или суставов.
Протезы суставов улучшают качество жизни, но они могут выйти из строя, что требует ревизионного или резекционного эндопротезирования. Причинами могут быть асептическая нестабильность эндопротеза, инфекция, вывих и перелом протеза или кости.
Хотя ПИ встречается редко, она является наиболее серьезным осложнением, возникающим в 0,8-1,9% случаев после эндопротезирования коленного сустава и в 0,3-1,7% случаев после эндопротезирования тазобедренного сустава (Phillips, 2006; Choong, 2007; Pulido, 2008).
К факторам риска со стороны пациента относятся предыдущая ревизионная артропластика или инфекция, связанная с протезированием сустава в том же месте; табакокурение, ожирение, ревматоидный артрит, новообразования, иммуносупрессия, сахарный диабет.
К факторам хирургического риска относятся одновременная двусторонняя артропластика, длительное время операции (>2,5 ч) и гемотрансфузия.
К факторам послеоперационного риска — осложнения заживления ран (например, поверхностная инфекция, гематома, замедленное заживление, некроз и расхождение краев раны), фибрилляция предсердий, инфаркт миокарда, инфекция мочевыводящих путей, длительное пребывание в стационаре и бактериемия, вызванная золотистым стафилококком (Peersman, 2001; Choong, 2007; Pulido, 2008).
Патогенез ПИ включает в себя взаимодействие между имплантатом, иммунной системой человека и микроорганизмом/микроорганизмами. Для засева имплантата необходимо лишь небольшое количество микроорганизмов, которые прилипают к имплантату и образуют биопленку, в которой они защищены от обычных антимикробных препаратов и иммунной системы (Pozo, 2007).
Микроорганизмы-возбудители часто инокулируются микробиотой кожи при установке имплантата, хотя засевание имплантата может происходить и после его установки, гематогенно или через поврежденные смежные ткани. Наиболее частыми возбудителями инфекции являются коагулазонегативный и золотистый стафилококки, на долю которых приходится более половины случаев инфицирования протезов бедра и коленного сустава (Trampuz, 2007). В остальных случаях причиной заболевания являются другие бактерии и грибки (Marculescu, 2006).
Наиболее частым симптомом является боль в суставе. В некоторых случаях могут присутствовать местные признаки инфекции (например, эритема, отечность и гипертермия сустава). Лихорадка часто отсутствует. При хронической инфекции может наблюдаться только боль, иногда в сочетании с расшатыванием протеза и дренированным синусом.
Хотя наличие дренированного синуса является патогномоничным для ПИ, во многих случаях они отсутствуют. В некоторых случаях бывает сложно отличить ПИ от неинфекционных причин неудачного эндопротезирования.
Хотя риск развития ПИ наиболее высок в раннем послеоперационном периоде, он сохраняется в течение всего срока службы сустава, при этом наиболее часто ПИ проявляется в течение первого года (Patel, 2023).
Диагностическими критериями являются:
- Две положительные культуры одного и того же микроорганизма (включая синовиальную жидкость, ткани и соникат).
- Синусовый тракт с признаками сообщения с суставом (Parvizi, 2018).
Анализы крови, включая измерение С-реактивного белка и, в меньшей степени, интерлейкина-6, скорости оседания эритроцитов или определение D-димера, могут быть полезны, но результаты этих тестов сами по себе не являются диагностическими, могут дублировать друг друга и не предоставлять микробиологической информации (Parvizi, 2018; McNally, 2021; Tai, 2022).
Целью лечения является подавление инфекции, предотвращение ее рецидивов и обеспечение безболезненного функционирования сустава. Антибактериальная терапия без хирургического вмешательства в большинстве случаев не приносит результата, поэтому важно провести тщательную хирургическую дебридментацию. При остром течении ПИ тазобедренного или коленного сустава обычно проводят хирургическую обработку и антибиотикотерапию с сохранением имплантата (Bedair, 2020).
Хронические инфекции требуют резекционной артропластики, либо одноэтапной (удаление инфицированного протеза и реимплантация нового протеза в ходе одной процедуры), либо двухэтапной ревизии. Суставные прокладки из полиметилметакрилата с антибиотиками, используемые при двухэтапной ревизии, помогают сохранить функцию в течение безпротезного периода (Craig, 2022).
Если пациенты не являются кандидатами на операцию, можно попытаться провести антимикробную супрессию. Такой подход вряд ли поможет вылечить инфекцию, поэтому антибиотикотерапия часто является пожизненной. Если после операции ожидается неприемлемая функция сустава или инфекция сохраняется, несмотря на хирургические усилия, иногда рассматривается возможность резекционной артропластики с созданием псевдоартроза при инфекции тазобедренного сустава (процедура Girdlestone) или артродеза или ампутации (как крайняя мера) при инфекции коленного сустава (Patel, 2023).
По сравнению с неинфицированными протезами ПИ ассоциируется с длительной госпитализацией, менее высокими показателями успешности, высокой степенью инвалидизации, снижением качества жизни и высокой смертностью. Обзор 29 исследований, проведенных в период с 2000 по 2020 год, показал, что средняя частота подавления инфекции после одноэтапного и двухэтапного тотального эндопротезирования коленного сустава составила 87% и 83% соответственно (Lazic, 2021).
Однако общий процент успешного завершения двухэтапной ревизии составляет менее 50%, при этом показатели завершения составляют 43% для тазобедренного сустава и от 11 до 48% для коленного (Corona, 2020; Kurtz, 2022).